外周VA-ECMO中的肢体缺血:关于发病率、预防、监测和治疗的叙述性综述(一)
转自体外生命支持分会ChELSA
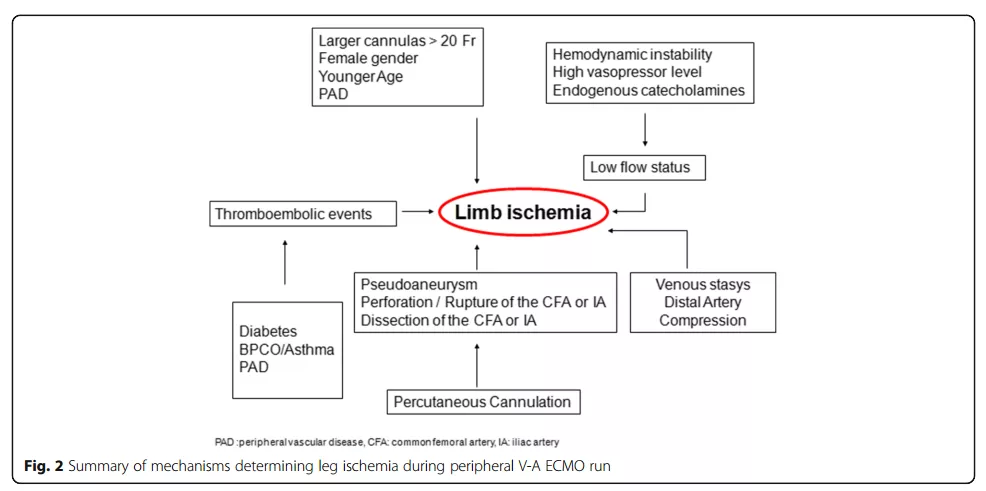
外周VA-ECMO中的肢体缺血:关于发病率、预防、监测和治疗的叙述性综述(一) Limb ischemia in peripheral veno-arterial extracorporeal membrane oxygenation: a narrative review of incidence, prevention, monitoring, and treatment Eleonora Bonicolini, et, al. Crit Care. 2019 Jul 30;23(1):266. doi: 10.1186/s13054-019-2541-3. 背景 静脉-动脉体外膜肺氧合(VA-ECMO)在难治性心脏病或心肺衰竭患者中的应用越来越多。在成人患者中,有两种VA-ECMO插管方式:中央型(cV-A ECMO),升主动脉插管和右心房插管;更常见的是外周型(pV-A ECMO),采用股或腋动脉插管。 心脏术后休克(PCS)患者更常进行中央插管,可以提供更好的大脑和上半身灌注,但并发症(如出血、感染和输血需求)较多,需要权衡利弊。 而在心脏骤停情况下,外周插管,特别是经股动静脉插管,因为可以在床旁快速有效的建立,已经成为外科切开插管插入的首选位置。然而,股动脉插管可导致同侧肢体缺血,这与插管插入点远端腿部的血流和氧气输送减少等多种机制有关。 最近的研究表明肢体缺血对患者死亡率和生存质量有消极影响。因此,早期诊断和预防腿部缺血尤为重要。然而相关循证依据缺乏。本文对文献进行了叙述性综述,重点介绍了发生率、确定的危险因素、病理生理学、监测技术、预防策略以及在pV-A ECMO期间远端肢体缺血的治疗选择。 方法 对2008年1月至2018年11月期间发表的关于成人(18岁或以上)的相关研究进行了文献回顾。检索词:“(ECMO OR ECLS) AND (((limb OR leg) AND (ischemia OR hypoperfusion)) OR ((peripheral OR arterial) AND cannulation)).”仅纳入英文研究。共获得184篇文章。 图1. 文献回顾和筛选的流程图 纳入标准:报道病例数超过10人,有报道pV-A ECMO的插管细节和腿部并发症。最终纳入28篇 表1(未列出,详见原文)总结了所选文章的主要发现。提取以下数据:研究设计、患者人数、年龄、主要并发症、肢体缺血患者百分比、ECMO时间、医院死亡率、插管和拔管策略、远端灌注插管(DPC)放置的形式和时间,以及其他预防或治疗肢体缺血的策略。 文献回顾 1.pV-A ECMO中肢体缺血的发生率 据报道,与股动静脉pV-A ECMO相关的肢体缺血发生率在10%到70%之间。这种变化较大的发病率是由于各报道在基线特征、ECMO适应症、插管技术、肢体缺血定义、检测工具、DPC置入模式和时间不均衡。 Yang等人在他们对使用股动静脉pV-A ECMO支持的成年患者的研究中,报告了较低的肢体缺血发生率(8.6%),部分原因可能是手术插管时大多数患者都预防性进行了DPC的置入。尽管如此,在一项84名因心脏或呼吸衰竭接受V-A ECMO治疗的成人患者的回顾性研究中,Tanaka发现,即使在预防性植入DPC的情况下,仍有12%的远端肢体缺血,需要筋膜切开,这与Yen等人的研究结果一致,即使使用DPC,33%的患者也会出现肢体缺血。 为了区分组间并发症的发生率,仅有两篇文献可用来分析心源性休克患者:其中一篇是109名患者,报告了16次肢体缺血(14.7%),9次筋膜切开术(8.3%),1例远端截肢(0.9%)。 三篇关于ECPR后建立pV-A ECMO的下肢缺血的研究:汇集253名患者的研究数据后,共检测到27例肢体缺血(10.6%)。其中,在Voicu等人的研究中死亡率很高,没有外周并发症可能与明较高显的早期死亡率有关。 两项研究是联合使用pV-A ECMO和主动脉内球囊反搏(IABP)。通过收集55例患者的数据,我们发现4例肢体缺血发作(7.2%),该研究表明IABP对其具有保护作用。 当ECMO、Impella、IABP、人工心脏这些短期心室辅助装置联合使用进行左心室辅助时,肢体缺血的发生率可能更高。最近,Russo等人回顾了17例观察性研究,包括3997例患者:其中1696例(42%)患者在V-A ECMO期间联合应用左室辅助装置,91.7%的患者联合使用了IABP,5.5%的患者联合使用了Impella。在这项荟萃分析中,与单独接受V-A ECMO支持的患者相比,接受V-A ECMO联合另一种左心辅助装置治疗的患者的肢体缺血率(RR 1.07;95%CI 0.90-1.27;p=0.47)没有显著差异。 2. 病理生理学与危险因素 pV-A ECMO患者的肢体缺血原因很多,可在ECMO运行的任何阶段发生(图2)。 图2. pV-A ECMO期间腿部缺血的机制总结 3. 诊断 外周动脉疾病管理共识(TASC II)将急性肢体缺血定义为:肢体灌注突然减少导致肢体功能不全。最新的AHA/ACC指南有一个关于血流动力学支持期间肢体缺血的特殊章节,称为“无症状动脉疾病”,即在进行需要大管径插管的生命支持治疗患者中发生的血管阻塞性疾病。 表1. 早期诊断方法 4. 临床体征和诊断工具 Pratt在1954年将急性肢体缺血的临床模式描述为6P体征:苍白、无脉搏、感觉减退、麻痹、疼痛和充血。 指南建议pV-A ECMO可使用超声引导下插管,以选择最佳插管位置,避免动脉粥样硬化,保留股深动脉起源及其侧支向肢体的流动,提供有关血管大小信息以减少即时和晚期并发症。可以提高一次插管的成功率和降低腹股沟血肿率。在pV-A ECMO支持期间,可以通过在靠近多普勒探头的脚踝处放置一个血压计带来评估远端肢体灌注压力,低于50 mmHg的灌注压力表明肢体缺血。此外,多普勒超声(D-US)可用于监测远端动脉(如胫骨后动脉或足背动脉)的峰值收缩速度(PSV)。 NIRS在成人麻醉和重症监护中的应用越来越多。Wong等人对ECMO的患者同时监测了大脑和肢体灌。他们将NIRS监测纳入治疗方案,并确定当δ-rSO2低于基线40%或高于基线25%时需要干预。在pV-A ECMO患者中,监测两者的近红外光谱,还分别监测插管和非插管腿,用来区分插管相关梗阻(插管和非插管腿之间的δ-rSO2<15%)和其他原因的灌注不足。 To be continued 本期文献回顾:卞璐瑜 中国医学科学院阜外医院